

近日,在IF87的國際頂級期刊《Nature Medicine》同期刊登2篇文章,聚焦突變特異性基因編輯在肥厚型心肌病治療前景中的新突破。Chai等人和Reichart等人報告了基于基因編輯的新精準療法的臨床前研究,以期在癥狀發生前糾正導致肥厚型心肌病的致病變異MYH7 c.1208G>A(p.R403Q),實現“一次治療,永久治愈”的長遠目標。


在《Base editing correction of hypertrophic cardiomyopathy in human cardiomyocytes and humanized mice》文章中,確定了一個腺嘌呤堿基編輯器(ABEs)和單鏈向導RNA(sgRNA)系統,在選定的位點以最小限度的旁觀者編輯(bystander editing)和脫靶編輯可以有效地糾正MYH7基因上的p.R403Q致病變異(PV)。結果表明,在源自肥厚型心肌病(HCM)患者的誘導性多能干細胞(iPSc)心肌細胞和HCM人源化小鼠模型中,堿基編輯成分的傳遞可挽救HCM的病理表現。該研究證明了堿基編輯在治療遺傳性心臟病方面的潛力,并促進了腺嘌呤堿基編輯器療法的進一步發展,以糾正導致心臟病的單基因變異。 最常見的遺傳性心臟病是肥厚型心肌病(HCM),它是由編碼心肌肌小節相關蛋白的基因變異引起,并導致異常的心肌肥厚。HCM的并發癥包括心力衰竭、心律失常和心原性猝死。MYH7(編碼β-肌球蛋白)的顯性負向c.1208G>A(p.R403Q)變異是一種常見且研究充分的PV,可導致心臟收縮力增加和HCM發病。
HCM患者iPSCs的ABE糾正效率
為了將ABEmax-VRQR和h403_sgRNA系統應用于疾病模型,研究人員從2名攜帶MYH7403/+ PV(HCM1403/++和HCM2403/+)的HCM患者中獲得了人類iPSCs。通過ABEmax-VRQR-P2a-EGFP和h403_sgRNA的質粒轉染、GFP+細胞熒光激活細胞分選來糾正MYH7403/+變異(圖1a)。通過高通量測序(HTS),盡管有98%-99%的靶點編輯,但在使用生物信息學工具CRISPOR后確定的8個檢測候選脫靶基因座的所有58個腺嘌呤堿基上,脫靶DNA編輯極少甚至沒有(0.12%或更少)(圖1b)。結果表明,具有ABEmax-VRQR的h403_sgRNA可以有效且特異性地糾正目標致病性錯義變異,在檢測的脫靶位點僅需極少的旁觀者編輯和很少或沒有DNA編輯。
ABE編輯患者來源iPSC-CMs的功能分析
為了研究基因編輯糾正是否能減少HCM患者的超收縮力的產生,研究人員將iPSC-CMs以單細胞密度放置在柔軟的聚二甲基硅氧烷表面上,記錄心肌細胞(CMs)收縮的高幀率視頻并計算峰值收縮力(圖1c)。由于先前的研究表明p.R403Q HCM變異導致ATP消耗增加和細胞代謝改變,接著又通過基因編輯糾正后的代謝通量測定評估細胞能量學的變化(圖1d)。結果表明,在人類HCM的CMs中,PV的糾正足以挽救超收縮表型并恢復正常的細胞能量。
圖1. 基于堿基編輯糾正的HCM患者iPSC-CM的功能分析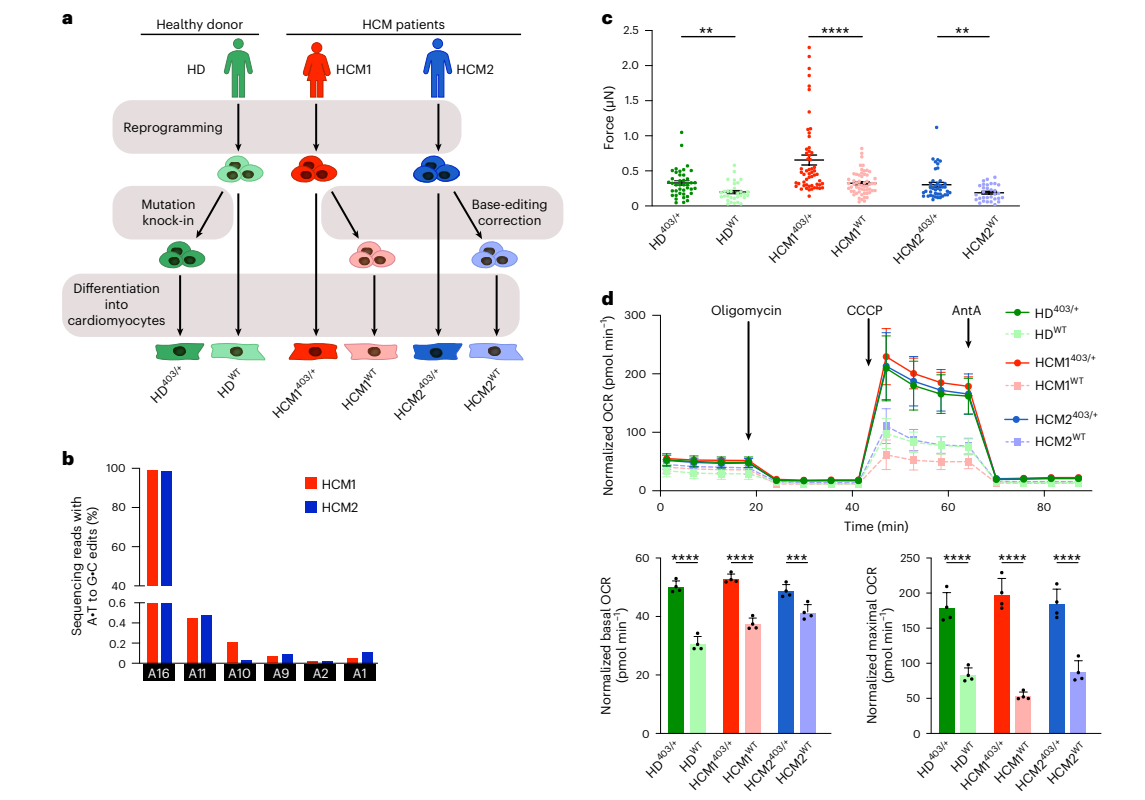
HCM生物學人源化小鼠模型的建立
與人類心臟中主要表達的β-肌球蛋白重鏈異構體不同,成年小鼠心臟主要表達α-肌球蛋白重鏈異構體,由MYH6編碼。以往的HCM小鼠模型都是用MYH6突變直接替代MYH7突變以解釋表達差異,但這二者在蛋白編碼區并不是完全相同的,因此用于人類基因組的sgRNA和編輯策略無法直接應用至小鼠模型。為了使用人類序列特異性堿基編輯策略進行臨床前研究,研究人員建立了一個人源化小鼠模型,在小鼠MYH6基因中包含MYH7 c.1208G>A(p.R403Q)人類錯義變異,該基因也具有PV上游和下游的至少21個核苷酸的人類DNA序列同一性,以便檢測人類基因組特異性CRISPR策略。另一個MYH6等位基因包含未修飾的小鼠基因組序列。這種人源化小鼠模型(MYH6h403/+)反映了先前描述的MYH6 p.R403Q小鼠模型的表型。
人類HCM小鼠模型的體內ABE治療
研究人員首先試圖通過挽救MYH6h403/h403小鼠來驗證雙AAV9 ABE系統的效率,這些小鼠在出生后一周內就會死亡。值得注意的是,目前沒有報道人類患者具有純合子基因型。用生理鹽水、低劑量(4×1013 vg kg-1)或高劑量(1.5×1014 vg kg-1)的AAV9(低劑量共為8×1013 vg kg-1,高劑量共為3×1014 vg kg-1)向P0(出生后第0天)的MYH6h403/h403幼崽胸腔內注射,并監測其發育情況。結果MYH6h403/+和MYH6WT小鼠在斷奶后存活并進入成年。高劑量小鼠心臟的互補DNA(cDNA)的Sanger測序表明,在轉錄水平上致病性核苷酸糾正了35%,這表明雙AAV9 ABE系統能夠在心臟中進行基因編輯(圖2)。 由于MYH7 p.R403Q變異僅以雜合形式存在于人類患者中,接下來又設置了雙AAV9 ABE系統來預防MYH6h403/+小鼠中HCM疾病的發生。結果發現,與MYH6WT對照組相比,MYH6h403/+小鼠的HCM特征增加,包括舒張期左室前壁(LVAW)厚度增加和舒張期左室后壁(LVPW)厚度增加。這些小鼠在舒張期和收縮期的左室內徑減小,左室射血分數(EF)和左室縮短分數(FS)增加。MYH6h403/+小鼠的心室壁厚度增加,心室直徑減小以及正常高值FS,這與人類患者的臨床進展一致。這些數據表明,雙AAV9 ABE系統治療足以預防HCM介導的心臟病理性重塑的發生(圖2)。
圖2. 對Myh6h403/+小鼠進行雙AAV9 ABE系統編輯預防HCM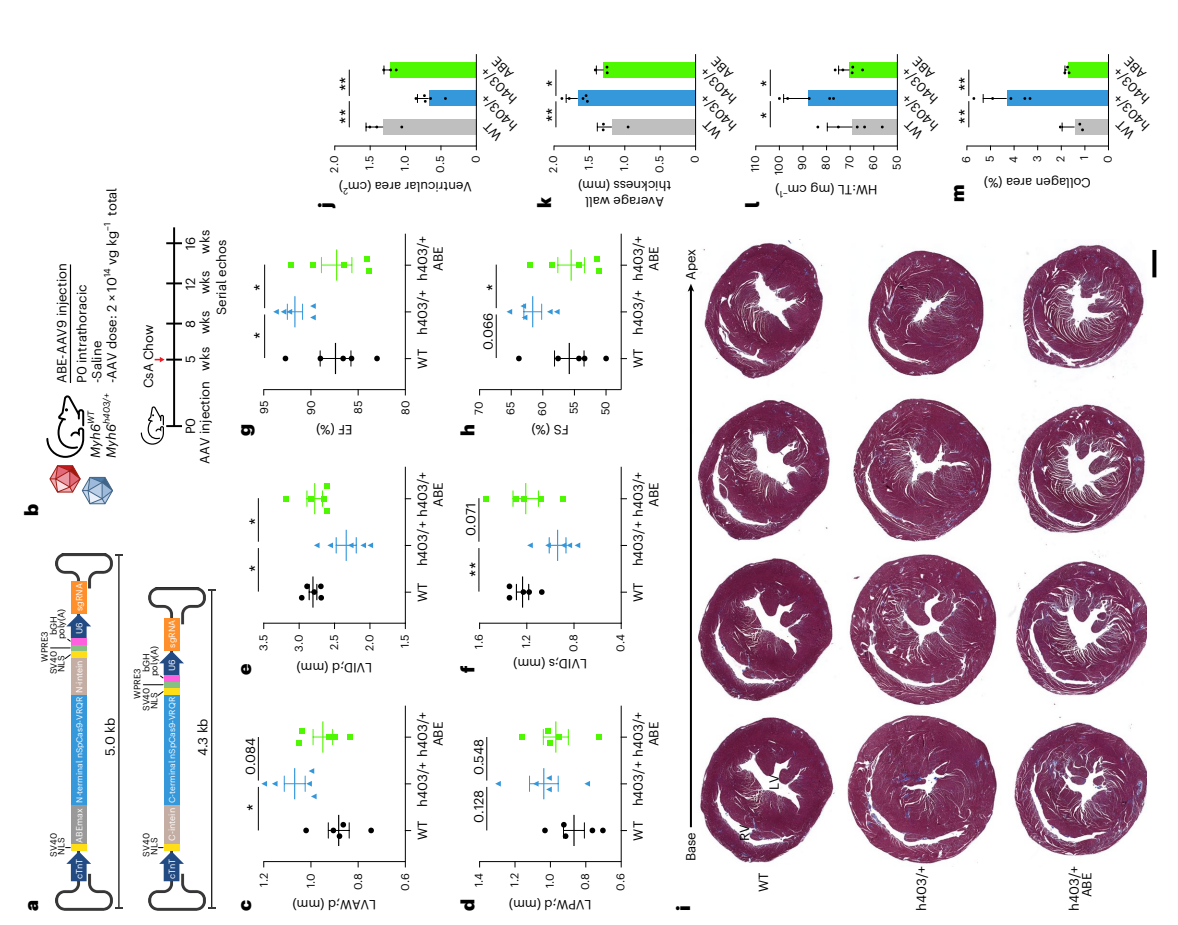
而在《Efficient in vivo genome editing prevents hypertrophic cardiomyopathy in mice》文章中,研究人員構建了可模擬人類肌球蛋白R403Q突變的小鼠模型,其病理特征和人類疾病表現類似,包括左心室肥大、心室腔縮小以及心肌纖維化。基于該動物模型,研究人員評估了兩種不同的基因療法——腺嘌呤堿基編輯器(ABE8e)和由AAV9遞送的強效Cas9核酸酶,來預防攜帶雜合HCM致病變異肌球蛋白R403Q的小鼠發生心臟病變。利用單劑量的AAV9雙載體,每個載體攜帶一半的RNA引導的ABE8e,糾正了≥70%的心室心肌細胞的致病變異,并保持了持久且正常的心臟結構和功能。額外的劑量雖然提升了心房處的編輯效率,但也增加了旁觀者編輯現象的發生。RNA引導的Cas9核酸酶的AAV9遞送有效地滅活了致病等位基因,但由于劑量依賴性的毒性,需要一個狹窄的治療窗口來維持健康。這些臨床前研究表明,單劑量基因療法在糾正或沉默致病變異、預防HCM發展方面具有相當大的潛力(圖3)。
圖3. 致病性變異R403Q的AAV9-Cas9沉默和R403Q-129SvEv小鼠的心臟功能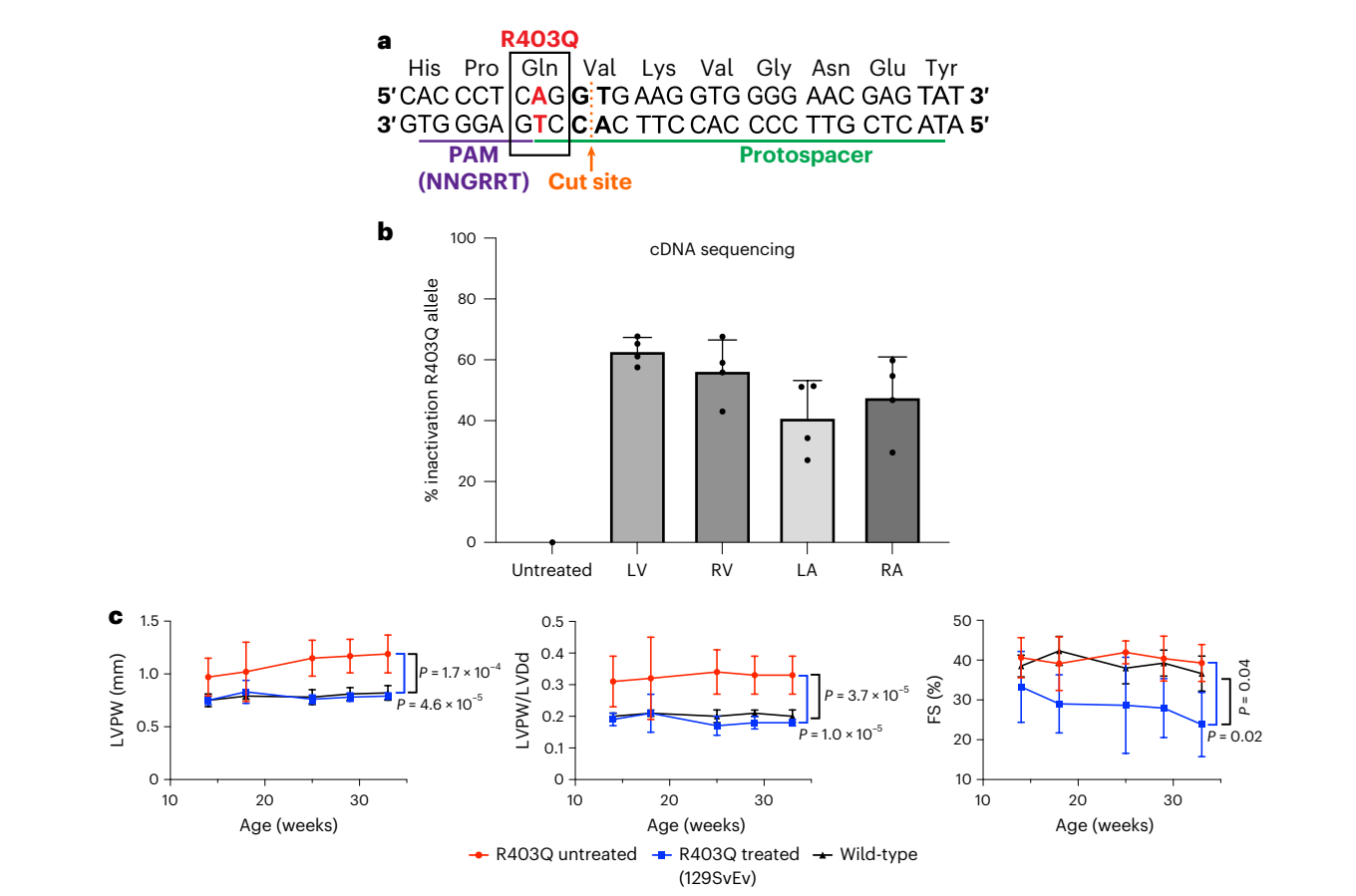
以上兩項基于基因編輯的新精準療法的臨床前研究,為HCM模型的成功基因編輯提供了希望,雖然將其轉化為人類患者還需面臨各種挑戰,但單劑量明確的治療方法不僅適用于HCM,也適用于基因敲除或過度表達策略不適用的眾多其他遺傳性綜合征,因此是一個非常值得追求的目標。在未來,基因編輯應用于臨床的精準治療指日可待!
參考文獻
[1] Chai AC, Cui M, Chemello F, et al. Base editing correction of hypertrophic cardiomyopathy in human cardiomyocytes and humanized mice. Nat Med, 2023 Feb; 29(2): 401-411. [2] Reichart D, Newby GA, Wakimoto H, et al. Efficient in vivo genome editing prevents hypertrophic cardiomyopathy in mice. Nat Med, 2023 Feb; 29(2): 412-421. 往期回顧 《心肌病中的致病變異會損害細胞組成和單細胞轉錄?Science 最新研究給你答案》