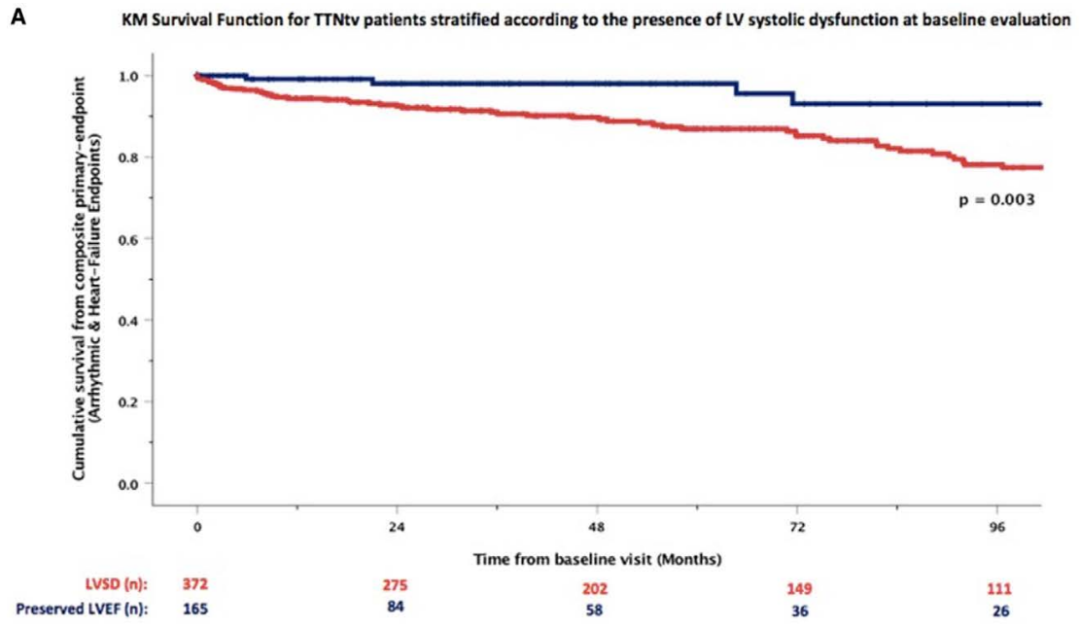
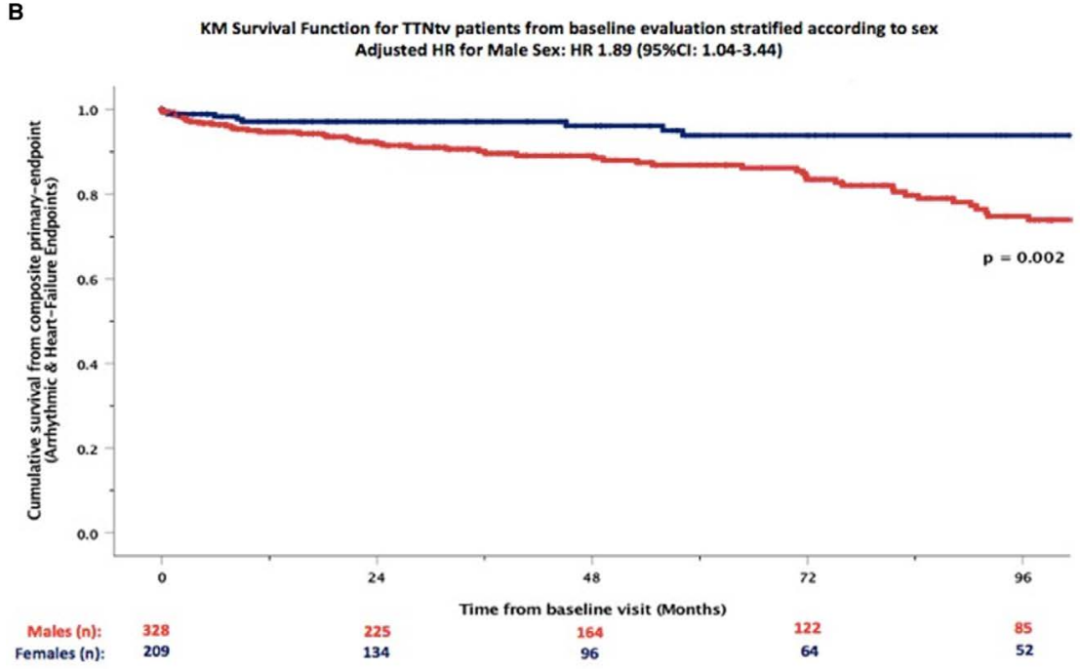
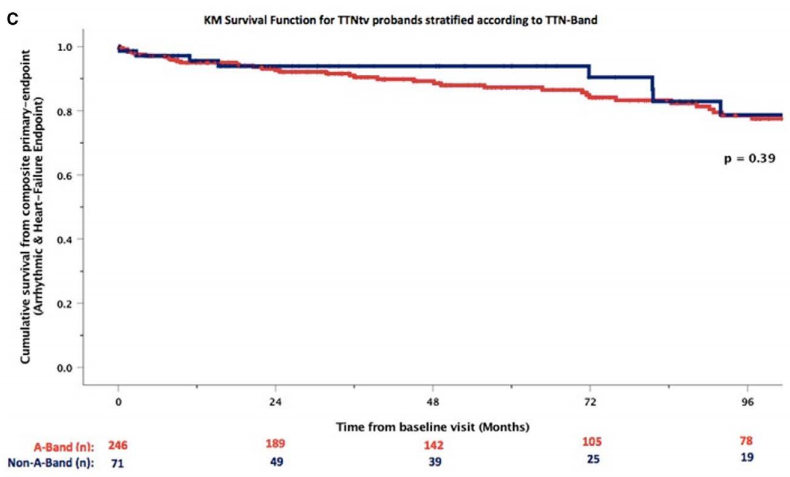
TTN基因上的截短變異(TTNtv)是導致遺傳性擴張型心肌病最常見的病因。近期,在《Circulation: Heart Failure》上刊登了一篇名為“Clinical Phenotypes and Prognosis of Dilated Cardiomyopathy Caused by Truncating Variants in the TTN Gene”的文章,該文章旨在探討TTN基因上的截短變異(TTNtv)攜帶者的臨床表型和臨床結局。
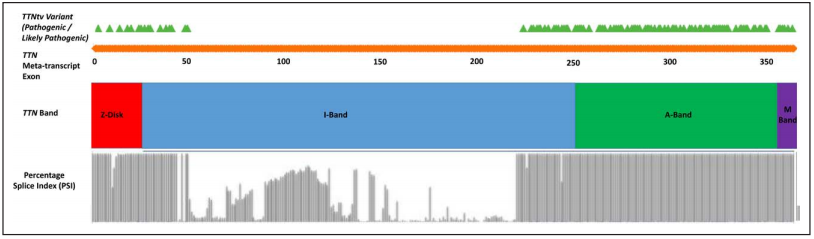
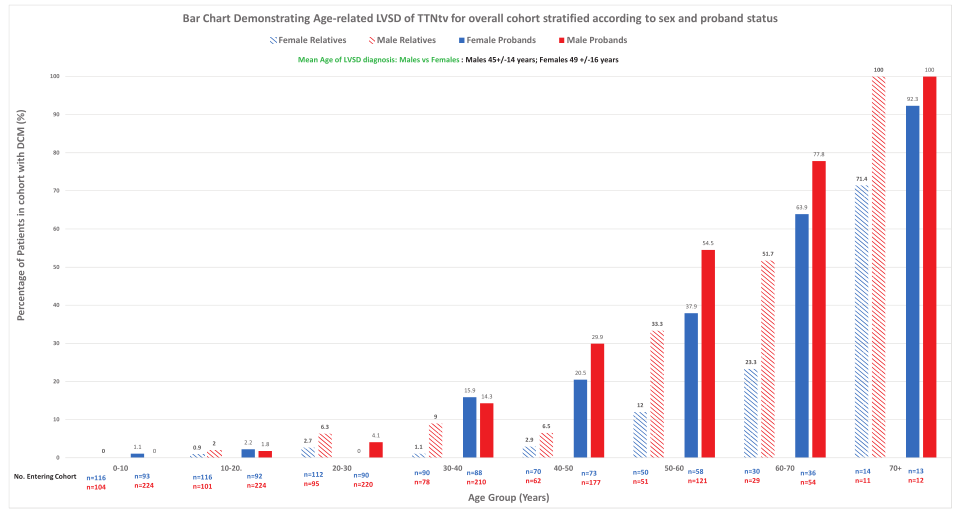
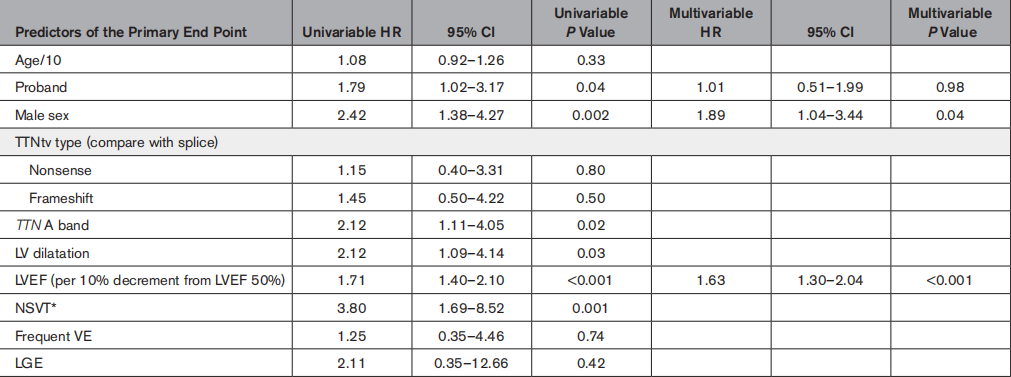
背景介紹 擴張型心肌病(DCM)的發病率約為1:250,是世界范圍內心臟移植最常見的病因。超過25%的擴張型心肌病患者具有遺傳傾向,新的數據表明基因型在擴張型心肌病的預后和治療上有重要影響。TTN基因編碼巨大的肌聯蛋白(titin),該基因上的截短變異(TTNtv)是DCM最常見的遺傳亞型,占病例總數的25%。肌聯蛋白是一種完整的肌節蛋白,參與被動力傳遞,并在肌節組織、彈性和細胞信號傳導中發揮重要作用。 研究方法 在14個中心(372例(69%)為左心室收縮功能障礙(LVSD)的患者)招募了537例攜帶TTNtv的患者(61%為男性;317例先證者)。獲得基線和縱向臨床數據,主要終點是惡性室性心律失常和終末期心力衰竭。次要終點是左心室逆重構(左心室射血分數增加≥10%或正常化至≥50%)。 研究結果 對317例攜帶TTNtv的先證者進行變異位置劃分(如圖1),發現246例(78%)先證者攜帶的TTNtv位于A-帶,71例(22%)先證者攜帶的TTNtv位于非A-帶(I-帶45例(14%),M-帶18例(6%),Z-盤區8例(2%))。 圖1. 顯示在該隊列中TTN基因上的截短變異(TTNtv)相對于TTN區帶的位置 注:綠色三角形表示不同TTNtv的位置,下面的橙色條表示TTN轉錄本中相應的外顯子位置,橙色條下面顯示相應的TTN區帶。細灰色條表示不同外顯子的剪接百分比指數(PSI),如先前的研究所述(http://www.cardiodb.org/titin)。所有合并的TTNtv都位于PSI>90%的外顯子中,并且是構成性的,包括TTN的N2B和N2BA亞型。 然而,男性更可能是先證者(68% vs 45%;P<0.001)。男性先證者也更有可能被歸為紐約心臟協會的III至IV級(44% vs 33%;P=0.07)和基線左心室射血分數較低(29±13% vs 32±11%;P=0.04)。男性先證者在基線動態心電圖上有較高的房顫發生率(20% vs 5%;P=0.009),非持續性室性心動過速(58% vs 42%;P=0.046)和基線心臟磁共振上的釓劑延遲增強(59% vs 32%;P=0.004)。男性和女性先證者在基線動態心電圖上的心室異位負荷相似(P=0.71)。 在基線評估中,有372例(69%)患者有LVSD,49例(9%)患者有心臟異常提示表型表達,包括心電圖異常T波倒置,孤立性左心室擴張,心臟磁共振上的釓劑延遲增強,房性或室性心律失常,以及116例(22%)表型陰性。在中位隨訪49(18-105)個月(每年共2822例患者)期間,25例(4.7%)基線左心室射血分數正常的患者發生LVSD。通過最終的評估,397例(74%)患者有LVSD的證據,39例(7%)有提示表型表達的心臟異常。 男性攜帶TTNtv的患者LVSD發生頻率較女性高,發病年齡較女性小(85% vs 57%;平均診斷為LVSD的年齡為45±14 vs 49±16,P=0.04)(如圖2)。 圖2. 條形圖顯示了TTN基因(TTNtv)隊列中所有的截短變異的年齡相關左心室收縮功能障礙(LVSD),并根據性別和先證者狀態分層 主要終點的單變量基線預測值如表1所示。將單變量P<0.05的基線參數納入多變量模型,首先包括先證者狀態,然后對其他基線變量進行正向條件Cox回歸多變量建模。由于只有少數患者接受基線動態心電圖監測,NSVT被排除在多變量模型之外,以盡量減少不完整數據的病例審查。多變量模型首先包括先證者狀態,其次是男性性別,A-帶TTNtv突變位置,左心室擴張和LVEF。納入482例患者(71例事件)的多變量Cox回歸分析表明,男性性別和LVEF是主要終點的獨立預測因子(表1;圖3A和3B)。 表1. 使用從臨床評估、心電圖、經胸超聲心動圖、心臟磁共振和動態心電圖獲得的基線臨床數據,對主要終點進行單變量和多變量預測 注:多變量Cox回歸模型不包括NSVT,以最小化病例審查。首先先證者狀態被納入模型,并使用性別、LVEF、LV擴張和TTN基因A-帶位置進行正向條件Cox回歸。由于缺乏統計學意義,TTN基因A-帶位置(P=0.07)和LV擴張(P=0.23)從多變量建模方程中刪除。 圖3A. 根據基線左心室收縮功能障礙(LVSD)對復合主要終點進行基線評估,基線LVSD患者發生71例終點事件,而基線左心室射血分數(LVEF;P=0.003)正常的患者發生5例終點事件 圖3B. 根據男性性別對復合主要終點進行基線評估,男性患者發生61例終點事件,女性患者發生15例終點事件(P=0.002) 與單變量分析的非A-帶TTNtv患者相比,A-帶TTNtv患者從基線臨床評估的復合主要終點的累積生存率降低,但在基線評估的多變量模型、或在出生或基線評估的單變量先證者分析中無統計學意義(圖3C)。類似地,當評估TTNtv定位于內部TTN啟動子Cronos之前或之后的先證者時,從出生開始的復合主要終點(P=0.73)或基線臨床評估(P=0.39)的累積生存率無統計學上的顯著差異。 圖3C. 根據A-帶的TTN突變位置對TTN先證者的復合主要終點進行基線評估,在TTN基因(TTNtv)患者中,A-帶截短變異發生50例終點事件,而非A-帶TTNtv患者發生11例終點事件(P=0.39) 結論 TTNtv引起的擴張型心肌病以頻繁的房性和室性心律失常為特征,且伴有最佳藥物治療(OMT)的左心室逆重構(LVRR)發生率高。惡性室性心律失常事件(MVAs)主要與嚴重的左心室收縮功能障礙(LVSD)有關。男性性別和LVSD是不良臨床結局的獨立預測因子。當考慮到TTNtv致病或可能致病的嚴格標準時(http://www.cardiodb.org/titin),TTNtv的位置(主要在成人剪接的TTN亞型中)不影響臨床表型或臨床結局。 新觀點是什么? ·與女性相比,男性與更嚴重的臨床表型和不良臨床結局相關。 ·男性性別和左心室射血分數是不良事件的獨立預測因子。 ·主要在成人剪接的TTN亞型中,伴有A-帶或Cronos的TTN基因突變位置的截短變異,不影響臨床表型或臨床結局。 ·藥物治療常出現左心室逆重構,但長期來看左心室收縮功能會惡化。 臨床意義是什么? ·惡性室性心律失常主要發生在有嚴重左心室收縮功能障礙的患者中,建議對晚期患者預防性植入心律轉復除顫器。 ·對最佳藥物治療的良好反應強調,一旦出現左心室收縮功能障礙,就需要鑒別和治療TTN基因截短變異的患者。 ·患者應保持密切監測,以發現初次左心室逆重構后的房性和室性心律失常以及左心室收縮功能障礙復發。 參考文獻 Akhtar MM, Lorenzini M, Cicerchia M, et al. TTN Clinical Phenotypes and Prognosis of Dilated Cardiomyopathy Caused by Truncating Variants in the Gene.Circ Heart Fail, 2020 Oct; 13(10): e006832. 關于心肌病及相關內容的更多介紹,詳見: 《Nature子刊最新研究——常見的遺傳變異和可改變的危險因素是肥厚型心肌病易感性和表達性的基礎》 《AHA/ACC肥厚型心肌病的診斷和治療指南2020年更新》